Blog
Radioterapia em tumores pediátricos

INDICAÇÕES DE RADIOTERAPIA EM TUMORES PEDIÁTRICOS:
Avanços tecnológicos em radioterapia: da Radioterapia Conformada Tri- Dimensional à Radioterapia de Feixe de Intensidade Modulada e Radioterapia Guiada por Imagem
Vários dos avanços científicos médicos que surgiram nas últimas décadas também criaram uma vasta gama de opções terapêuticas para pacientes com câncer, em geral. Especificamente no campo da oncologia pediátrica, esses avanços podem se traduzir não apenas em armas terapêuticas mais eficazes no combate ao câncer, mas também em mecanismos que permitam aos médicos oferecer tratamentos menos tóxicos e com menor risco de efeitos colaterais a curto e longo prazo. É o caso da radioterapia, em que novas possibilidades de intervenções técnicas permitem reduzir os possíveis efeitos colaterais associados à toxicidade inerente à radiação nos tecidos normais, graças a recursos mais precisos que proporcionam uma melhor distribuição da dose de radiação no tumor e nas áreas de risco (1) com consequente redução dos efeitos tóxicos. Além disso, o resultado de esforços coordenados e colaboração entre diferentes modalidades terapêuticas permitiu, em muitos casos, reduzir (ou mesmo eliminar) a dose da radioterapia, bem como reduzir seu impacto no que diz respeito às sequelas crônicas em pacientes curados que sobrevivem às suas doenças malignas (2,3).
Em paralelo, a melhoria contínua na classificação de risco tumoral (por exemplo, nas formas estadiamento, inclusive a molecular) permite uma melhor diferenciação entre as abordagens de tratamento. Pacientes com tumores de bom prognóstico recebem opções mais brandas e menos mórbidas e, para aqueles com tumores agressivos, busca-se intensificação terapêutica por meio de combinações multimodais. O impacto positivo dessa estratégia é reconhecido pela diminuição histórica da mortalidade tardia em pacientes curados de câncer infantil, tratados na década de 1990 em comparação com pacientes no início dos anos 1970, devido à redução de neoplasias primárias secundárias e condições crônicas graves, incluindo cardiotoxicidade e distúrbios pulmonares (4), entre outros. De forma análoga, o aumento das opções de tratamento geralmente permite que crianças com diagnóstico de câncer hoje tenham mais chances de cura, incluindo crianças diagnosticadas mais tardiamente, com doenças mais avançadas, ou com tipos de doença mais agressivos (5). Nestes casos, quando são expostos a mais tratamentos, são sempre mais propensos a apresentar efeitos tardios e, embora anteriormente não sobreviventes, atualmente representam cada vez mais uma parcela de pacientes curados e que demandam crescentemente por cuidados especializados, por equipes médicas e multidisciplinares altamente qualificadas (6). O reconhecimento das sequelas ao longo dos anos de seguimento permite inclusive intervenção precoce e redução dos danos, que podem ser progressivos e irreversíveis.
Antes de abordar a questão dos avanços tecnológicos e os benefícios da radioterapia em oncologia pediátrica, é necessário entender os conceitos relacionados à prescrição do tratamento radioterápico e suas diversas técnicas de administração de dose (7). Modificações no volume que recebe radiação ionizante; na dose, incluindo seu valor total, taxa de dose e fracionamento (ou seja, dose por sessão); nas características do feixe (corpuscular, como os prótons, ou eletromagnético, como os fótons); e dos órgãos tratados (neste caso, diferentes tecidos biológicos apresentam diferentes vulnerabilidades) (8), se refletem em diferentes reações radio-biológicas e, portanto, na resposta ao tratamento e nos tipos e graus de complicações. Essas variáveis são inclusive levadas em consideração em algoritmos matemáticos que preveem, (com certas limitações), a dose efetiva biológica (BED, "biologic effective dose") e permitem razoáveis comparações entre diferentes esquemas de prescrição de radiação.
Historicamente, os primeiros planos de radioterapia foram elaborados a partir de uma técnica denominada "convencional 2D", onde, entre outras características, a definição do alvo do tratamento era baseada apenas em radiografias ortogonais. No entanto, há várias décadas, a radioterapia tem se beneficiado dos avanços nos campos das ciências computacionais, que se refletiram na criação de modernos sistemas de planejamento que possibilitaram o advento da Radioterapia Conformacional Tridimensional (3D-CRT, “3D-Conformal Radiotherapy”) e, mais recentemente, da Radioterapia de Intensidade Modulada (IMRT, “Intensity Modulated Radiotherapy”) e sua variante Radioterapia de Arco Volumétrico Modulado (VMAT, “Volumetric Modulated Arc Therapy”), e da Radioterapia Guiada por Imagem (IGRT, “Image-Guided Radiotherapy”). Tais as técnicas são baseadas na localização do alvo usando imagens tomográficas (7) e as suas combinações permitiram também o advento das modalidades estereotáticas de radioterapia, como a Radiocirurgia (RCir) e a Radioterapia Estereotática Fracionada (SFRT, “Stereotactic Fracionated Radiotherapy”) e da modalidade ablativa de radioterapia, a Radioterapia Estereotática Corpórea (SBRT, “Stereotactic Body Radiotherapy”, também conhecida como Radioterapia Estereotática Ablativa Corpórea [SABR, “Stereotactic Ablative Body Radiotherapy”]).
Atualmente, 3D-CRT ainda é a técnica de radioterapia mais difundida e econômica, mesmo em pacientes pediátricos. A utilização de sistemas de tomografia computadorizada e planejamento permite, além do cálculo exato da dose de radiação administrada, a redução das margens de segurança aplicadas no volume de tratamento de radiação de forma que a quantidade de tecido normal irradiado seja proporcionalmente menor.
A IMRT, popularizada no Brasil desde o início do século XXI, infelizmente ainda não atingiu a capilaridade esperada, muito em parte pela sua somente parcial incorporação ao “Rol” da Agência Nacional de Saúde (ANS) e ausência de estímulo à incorporação ao Sistema Único de Saúde (SUS). A IMRT permite maior flexibilidade na distribuição da dose em redução ainda maior da dose em órgãos selecionados. Para pacientes na faixa etária pediátrica, além da possibilidade de manter a funcionalidade do órgão, à longo prazo, sem interferir na dose terapêutica ao alvo, outro potencial benefício dessa técnica seria uma maior tolerância aguda ao tratamento, graças à menor irradiação em tecidos saudáveis. No entanto, em crianças, os efeitos a longo prazo da IMRT anteriormente mencionados ainda estão sendo investigados, devido à maior exposição proporcional da superfície corporal a baixíssimas doses de radiação e, portanto, ao risco teórico de maior chance de induzir segundas neoplasias primárias (8).
A IGRT auxilia os tratamentos irradiantes por melhorar a precisão terapêutica por meio de imagens adquiridas no transcorrer da sessão de tratamento, permitindo uma eventual redução as margens ao redor do tumor, tanto na IMRT quanto na 3D-CRT. Nos pacientes pediátricos, os eventuais benefícios de um tratamento mais preciso ou com margens menores de tratamento também devem ser contrabalanceados com os possíveis efeitos a longo prazo, assim como com a IMRT, devido à eventual maior exposição proporcional do paciente a baixíssimas doses de radiação, visto que comumente a IGRT é realizada com raios-X (20).
Evolutivamente, a RCir consiste no uso de doses únicas e altas de radiação direcionada, com alto grau de precisão, para tumores intracranianos benignos ou malignos. A IGRT, então, permite a imobilização do paciente por máscaras de fixação não invasivas para a realização tanto da RCir quanto da SFRT, especificamente neste caso, com o uso de doses moderadas de radiação direcionada, mas em múltiplas doses e sessões de tratamento. Apesar de metástases cerebrais serem eventos pouco prevalentes entre os tumores malignos da infância, a RCir e a SFR são alternativas interessantes na irradiação de tumores malignos ou benignos pediátricos do SNC justamente pela alta precisão proporcionada (21).
A SBRT, por definição, é quando se utiliza a IGRT associado a um sistema de fixação adequado ao corpo do paciente, fora do crânio, e a um regime de prescrição de doses hipofracionada, muitas vezes chegando a doses de 20 Gy ou mais, por sessão, mas com um número reduzido destas sessões, de 10 ou menos, sendo então uma modalidade voltada ao tratamento de um volume alvo bem definido, e oferecendo baixas doses nos tecidos circunvizinhos. Dados ainda limitados estão atualmente disponíveis sobre os resultados clínicos de SBRT para pacientes pediátricos, adolescentes e adultos jovens com câncer. Recente revisão sistemática e meta-análise sugere resultados favoráveis de controle local, sobrevida e toxicidade após SBRT (22).
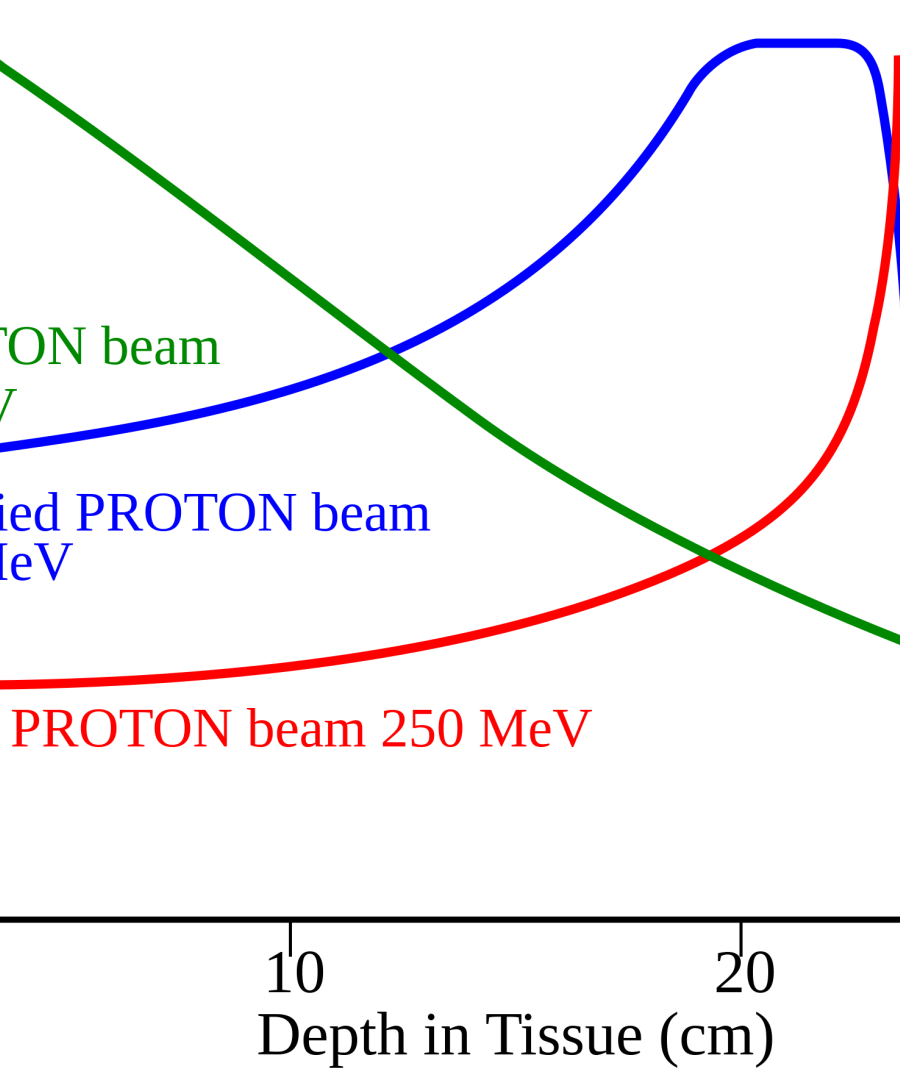
Contemporaneamente, há grande expectativa sobre os benefícios da radioterapia de prótons, ou prótonterapia. Ao contrário das técnicas já descritas, que se baseiam na aplicação de raios-X terapêuticos, a prótonterapia se baseia na aplicação de prótons, que são partículas elementares do núcleo atômico carregadas positivamente, e que também podem danificar o DNA das células tumorais. A principal vantagem da radioterapia de prótons é uma propriedade intrínseca chamada "pico de Bragg", no qual há uma região em que a maior parte da energia terapêutica é depositada, especificamente em uma certa profundidade do meio (pico). Isso se traduz em maior eficácia terapêutica devido à capacidade de confinar a maior parte da radiação à região onde o tumor está localizado e a uma redução consistente e substancial da radiação incidental para tecidos fora dessa região, em especial na “saída” do feixe de irradiação de prótons. No entanto, o grande "calcanhar de Aquiles" atual da radioterapia de prótons é seu alto custo, com os aparelhos custando cerca de dezenas de milhões de dólares (1) e os tratamentos custando dezenas de milhares de dólares. Por ora, evidências de grau moderado apoiam a prótonterapia como um tratamento com potencial benefício para irradiação cranioespinhal, com base no controle equivalente da doença e toxicidade comparável à da radioterapia por feixe de fótons (24).
Radioterapia pediátrica: aspectos gerais
De modo geral, independentemente da técnica de tratamento utilizada: 3D-CRT ou IMRT, a radioterapia é rotineiramente realizada em sessões diárias com a administração de pequenas frações da dose prescrição em cada sessão, que são somadas e totalizadas ao final. Na faixa etária pediátrica, dependendo do tipo de neoplasia e da indicação, as doses totais normalmente utilizadas variam de valores de apenas 150 cGy a valores de até 7000 cGy. Devido ao risco de efeitos tóxicos agudos, historicamente têm sido utilizadas pausas de 2 dias a cada 5 sessões de tratamento, e as doses diárias utilizadas no chamado fracionamento convencional variam de 150 a 200 cGy. Em crianças pequenas, especialmente aquelas com menos de 3 a 5 anos, as doses diárias são reduzidas para até 125 cGy devido a preocupações semelhantes de toxicidade aguda excessiva (2).
No contexto do tratamento oncológico pediátrico, a atuação do radio-oncologista, que indica e prescreve a radioterapia, deve ser integrada ao trabalho de outros especialistas, como oncologistas e cirurgiões pediátricos, anestesistas, enfermeiros, psicólogos e odontologistas, resultando em um trabalho interativo e coordenado compatível com o significado e a complexidade do paciente oncológico infanto-juvenil. É, portanto, bastante incomum que diferentes modalidades terapêuticas, médicas e não médicas, funcionem de forma totalmente isolada no cuidado de pacientes pediátricos. Na mesma perspectiva da multidisciplinaridade, um aspecto muito atual da radioterapia é que, embora tenha se desenvolvido consideravelmente nas últimas décadas, seu desenvolvimento tecnológico não a impediu de desempenhar um papel cada vez menos relevante no tratamento de vários tipos de neoplasias malignas pediátrica, como ocorre atualmente, por exemplo, na leucemia linfocítica aguda (10). Essa aparente contradição ocorre porque os resultados históricos positivos da radioterapia em termos de controle local da doença e aumento da sobrevida também revelaram o impacto negativo de efeitos colaterais de longo prazo, como a indução de segundas neoplasias primárias, alterações neurocognitivas e endocrinopatias. A constatação de que para curar os pacientes "cobra-se” também o alto preço dos efeitos colaterais (9, 11), desencadeou na busca por alternativas terapêuticas que ofereçam menor risco de complicações, mas com a mesma eficácia em termos de controle da doença e sobrevida (12-14). No entanto, em diversas situações, o tratamento menos tóxico também está associado a piores resultados de sobrevida, comprometendo o objetivo principal de curar pacientes com câncer, como historicamente demonstrado no tratamento do meduloblastoma (15). Outrossim, ainda são frequentes as situações em que a radioterapia é um elemento-chave como modalidade terapêutica principal ou adjuvante na busca de um equilíbrio satisfatório entre sobrevida e toxicidade tardia. Por exemplo, a radioterapia é frequentemente utilizada como adjuvante no tratamento cirúrgico de tumores do sistema nervoso central (SNC), pois o benefício complementar à ressecção de neoplasias muitas vezes supera quaisquer custos em termos de possível redução na qualidade de vida. As indicações mais comuns de radioterapia adjuvante em tumores do sistema nervoso central na infância são: meduloblastoma, ependimoma e até mesmo alguns tumores benignos como craniofaringioma. Por outro lado, a radioterapia pode ser utilizada em muitos casos de neoplasias de partes moles, substituindo um tratamento cirúrgico potencialmente mutilador, dado que a relação "controle da doença" versus "toxicidade" pode ser melhor quando se utiliza a radioterapia em detrimento da tentativa de ressecção radical. Por exemplo, a radioterapia pode ser indicada como parte integrante do tratamento de tumores da família de Ewing e rabdomiossarcomas quando há risco de mutilação com o tratamento cirúrgico convencional (16-19).
Irradiação de neuroeixo:
A irradiação de neuroeixo, ou cranioespinhal, é uma técnica abrangente de tratamento com radiação indicada para neoplasias cerebrais malignas que apresentam alto risco de envolvimento ou disseminação para o espaço liquórico, como o meduloblastoma. De fato, existem várias técnicas possíveis para irradiação do espaço liquórico, mas para todas elas, a disposição dos campos de tratamento geralmente envolve uma combinação de campos de irradiação cerebral e campos de irradiação adjacentes da medula espinhal.
Na técnica mais utilizada, baseada na radioterapia convencional ou 3D-CRT, o paciente é posicionado e imobilizado em decúbito ventral e campos laterais opostos no segmento cefálico (denominado "cérebro inteiro") são combinados com um (ou mais) campos póstero-anteriores no segmento da medula espinhal (denominado campo posterior direto). Por meio de radiografias convencionais ou imagens de tomografia computadorizada, é possível determinar a melhor forma de aplicar as doses de radiação prescritas (incluindo a proteção dos tecidos que não precisam ser irradiados), bem como determinar aspectos geométricos importantes para a segurança do tratamento, como os ângulos dos campos de tratamento e a separação desses campos (chamados de "gaps") quando adjacentes.
A complexidade da irradiação de neuroeixo deve-se em grande parte à determinação correta desses ângulos e principalmente dos gaps, a fim de evitar uma possível overdose de tecidos irradiados (por exemplo, a medula espinhal) devido à inclusão inadvertida de um segmento de tecido em dois campos de irradiação adjacentes. Se, por um lado, essa sobreposição de campos pode ser extremamente prejudicial ao paciente, por outro, utilizar gaps muito longos também significa subdosar os alvos do tratamento (como o espaço liquórico), o que pode levar ao insucesso terapêutico e a menores chances de controle e cura da doença (13).
Outro aspecto importante relacionado à segurança da irradiação neural é o fato de que tanto o grande número de campos de tratamento utilizados com sessões mais longas quanto o posicionamento em decúbito ventral são fatores que levam à baixa tolerância e consequente dificuldade na cooperação do paciente durante sua realização, muitas vezes exigindo o uso de anestesia ou sedação diária, principalmente em pacientes da primeira e segunda infância (até 6 a 7 anos).
Anestesia para radioterapia
A radioterapia sob anestesia é um cenário crítico para o tratamento de pacientes mais jovens, pois a imobilização é a pedra angular da administração correta da dose diária de radiação, tendo em mente que o tratamento é baseado na TC de planejamento, obtida no início do mesmo. A imobilização do paciente é particularmente importante ao usar técnicas modernas de tratamento e quando os alvos estão criticamente próximos de órgãos e tecidos que se almeja proteger.
Quase todas as crianças de 4 anos ou menos precisam de anestesia, junto com aproximadamente 50% das crianças de 4 a 6 anos e, em alguns casos, até crianças de 10 anos ou mais (25), em função de condição neurológica (por exemplo, distúrbios do movimento ou comprometimento cognitivo) ou sofrimento psicológico. Nestes casos, existem algumas intervenções que afetam a proporção de crianças capazes de tolerar o tratamento sem sedação e sem descontinuidade do mesmo, intervenções humanizadas com psicólogos que levaram à redução do uso da anestesia em até 40% dos casos avaliados (26). Além disso, a inclusão acolhedora de toda a equipe de radioterapia e uma sala de tratamento acessível e ampla o suficiente para permitir uma experiência lúdica são também usadas para fazer com que as crianças se sintam seguras o suficiente para receber tratamento enquanto acordadas e momentaneamente longe dos pais.
Para os pacientes que demandam o tratamento sob sedação, o anestesiologista deve estar atento aos efeitos colaterais e complicações que são influenciados pelo tipo e localização do câncer, o término da quimioterapia e a dinâmica de posicionamento de cada paciente dentro do acessório de imobilização específico. Da mesma forma, radioterapeutas e oncologistas pediátricos devem estar familiarizados com escalas de risco anestésico, tipos de anestésicos usados, duração e grau de sedação, disponibilidade de vias aéreas e outras condições médicas significativas e, antecipando cada novo regime de tratamento, de preferência logo após a primeira consulta com o radioterapeuta, o anestesiologista deve assumir o risco perioperatório do paciente.
O sistema de classificação do estado físico da Sociedade Americana de Anestesiologia (ASA-PS, “American Society of Anesthesiology – Physical State”) é um dos vários sistemas de classificação que estimam a mortalidade perioperatória em cirurgia não-cardíaca (26). A adequação deste sistema à rotina da radioterapia, geral ou pediátrica, deve-se à sua capacidade de traduzir o estado geral de saúde do paciente e associá-lo ao risco de morbi-mortalidade e isso pode-se bem correlacionar com estado clínico dos pacientes oncológicos, que normalmente têm comorbidades, síndromes paraneoplásicas ou toxicidades adquiridas pelo tratamento, que causam consequências para os sistemas cardiovascular e respiratório. Desta forma, a avaliação de risco clínico do paciente pediátrico em tratamento irradiante sob sedação deve ser revisada também diariamente em relação à fluidez do estado geral de saúde, exatamente em função da velocidade com que estas comorbidades, síndromes e toxicidades podem impactar a saúde deles, agudamente. Existem, por exemplo, protocolos de quimioterapia concomitante à radioterapia com altos índices de toxicidade reportados (28), que requerem uma rotina rigorosa de monitoramento dos índices hematimétricos. Febre e secreções mucosas de aparecimento recente também exigem eventualmente a suspensão das sessões de tratamento pelo risco de complicações (29), infelizmente com mais frequência do que o mecanismo teórico de eficácia terapêutica idealmente permite. Nesse sentido, todos os esforços devem ser feitos para evitar co-infecções, como: realizar triagem rápida de indivíduos infectados, aplicar medidas de isolamento de contato e reforçar hábitos de higiene com os familiares e acompanhantes dos pacientes.
Em conexão com as náuseas e hiporexia esperadas da própria radiação, o jejum necessário para a realização de sessões de tratamento sob sedação causam um grande impacto negativo no peso dos pacientes. Em princípio, a Sociedade Brasileira de Nutrição, de acordo com a Sociedade de Brasileira de Anestesiologia (30 - 32), estimulam um período menor de jejum por meio do uso de glicosoluções específicas para pacientes oncológicos: para evitar efeitos catabólicos do jejum, uma solução oral de carboidratos complexos, como dextrina de malte, em concentração relativamente alta (12,5%) é administrada até duas horas antes do procedimento, sendo permitido a ingestão de líquidos claros também até duas horas antes da indução da anestesia.
Medidas administrativas, como o agendamento do atendimento diário prioritário, inclusive por ordem crescente de idade e estado nutricional, é complementar no combate à desnutrição de crianças tratadas sob sedação, ou não. A escolha dos materiais e medicamentos utilizados, como drogas anestésicas de dissolução rápida, que não estimulem náuseas, e permitam uma recuperação anestésica melhor e mais rápida devem ser consideradas (33, 34).
Dados de literatura relatam uma baixa taxa de complicações em anestesia para radioterapia, sendo as complicações mais comuns: laringoespasmo, broncoespasmo, náuseas e vômitos, apneia e eventuais distúrbios de ritmo cardíaco. (29)
BIBLIOGRAFIA:
1-Magnuson WJ, Mahal A, Yu JB. Emerging Technologies and Techniques in Radiation Therapy. Semin Radiat Oncol. 2017 Jan;27(1):34-42.
2- Gibbs IC, Tuamokumo N, Yock TI. Role of radiation therapy in pediatric cancer. Hematol Oncol Clin North Am. 2006 Apr;20(2):455-70.
3- O'Leary M, Krailo M, Anderson JR, et al. Children's Oncology Group. Progress in childhood cancer: 50 years of research collaboration, a report from the Children's Oncology Group. Semin Oncol. 2008 Oct;35(5):484-93.
4-Armstrong GT, Chen Y, Yasui T, et al. Reduction in late mortality among 5-year survivors of childhood câncer. N Engl J Med 2016; 374:833-842.
5- Howlader N, Noone AM, Krapcho M, et al. SEER Cancer Statistics Review, 1975-2014, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2014/, based on November 2016 SEER data submission, posted to the SEER web site, April 2017.
6-Han JW, Kim HS, Kim BS, et al. Increasing and worsening late effects in childhood cancer survivors during follow-up. J Korean Med Sci. 2013 May;28(5):755-62.
7-Smith RP, Heron DE, Huq MS, et al. Modern radiation treatment planning and delivery--from Röntgen to real time. Hematol Oncol Clin North Am. 2006 Feb;20(1):45-62.
8-Veldeman L, Madani I, Hulstaert F, De Meerleer G, Mareel M, De Neve W. Evidence behind use of intensity-modulated radiotherapy: a systematic review of comparative clinical studies. Lancet Oncol. 2008 Apr;9(4):367-75.
9-Armstrong GT, Liu Q, Yasui Y, Huang S, Ness KK, Leisenring W, Hudson MM, Donaldson SS, King AA, Stovall M, Krull KR, Robison LL, Packer RJ. Long-term outcomes among adult survivors of childhood central nervous system malignancies in the Childhood Cancer Survivor Study. J Natl Cancer Inst. 2009 Jul 1;101(13):946-58.
10-Pui CH, Campana D, Pei D, et al. Treating childhood acute lymphoblastic leukemia without cranial irradiation. N Engl J Med. 2009 Jun 25;360(26):2730-41.
11-Hall EJ. Intensity-modulated radiation therapy, protons, and the risk of second cancers. Int J Radiat Oncol Biol Phys. 2006 May 1;65(1):1-7.
12-Mulhern RK, Kepner JL, Thomas PR, et al. Neuropsychologic functioning of survivors of childhood medulloblastoma randomized to receive conventional or reduced-dose craniospinal irradiation: a Pediatric Oncology Group study. J Clin Oncol. 1998 May;16(5):1723-8.
13-Kleinerman RA, Tucker MA, Tarone RE, et al. Risk of new cancers after radiotherapy in long-term survivors of retinoblastoma: an extended follow-up. J Clin Oncol. 2005 Apr 1;23(10):2272-9.
14-Armstrong GT, Liu Q, Yasui Y, et al. Long-term outcomes among adult survivors of childhood central nervous system malignancies in the Childhood Cancer Survivor Study. J Natl Cancer Inst. 2009 Jul 1;101(13):946-58.
15-Bouffet E, Bernard JL, Frappaz D, et al. M4 protocol for cerebellar medulloblastoma: supratentorial radiotherapy may not be avoided. Int J Radiat Oncol Biol Phys. 1992;24(1):79-85.
16-Packer RJ, Cogen P, Vezina G, et al. Medulloblastoma: clinical and biologic aspects. Neuro Oncol. 1999 Jul;1(3):232-50.
17-Fangusaro J. Pediatric high-grade gliomas and diffuse intrinsic pontine gliomas. J Child Neurol. 2009 Nov;24(11):1409-17.
18-Kalapurakal JA. Radiation therapy in the management of pediatric craniopharyngiomas--a review. Childs Nerv Syst. 2005 Aug;21(8-9):808-16.
19Stevens MC. Treatment for childhood rhabdomyosarcoma: the cost of cure. Lancet Oncol. 2005 Feb;6(2):77-84.
20-Bryce-Atkinson A, De Jong R, Marchant T, Whitfield G, Aznar MC, Bel A, van Herk M. Low dose cone beam CT for paediatric image-guided radiotherapy: Image quality and practical recommendations. Radiother Oncol. 2021 Oct;163:68-75.
21-Lo SS, Fakiris AJ, Abdulrahman R, Henderson MA, Chang EL, Suh JH, Timmerman RD. Role of stereotactic radiosurgery and fractionated stereotactic radiotherapy in pediatric brain tumors. Expert Rev Neurother. 2008 Jan;8(1):121-32.
22-Singh R, Valluri A, Didwania P, Lehrer EJ, Baliga S, Hiniker S, Braunstein SE, Murphy ES, Lazarev S, Tinkle C, Terezakis S, Palmer JD. Efficacy and Safety of Stereotactic Body Radiation Therapy for Pediatric Malignancies: The LITE-SABR Systematic Review and Meta-Analysis. Adv Radiat Oncol. 2023 Jan 5;8(2):101123.
23-Treatment Planning – Central Nervous System and Pituitary Gland. In: Gunilla C. Bentel, ed. Radiation Therapy Planning. New York: McGraw-Hill Professional, 1995:349–57.
24-Young S, Phaterpekar K, Tsang DS, Boldt G, Bauman GS. Proton Radiotherapy for Management of Medulloblastoma: A Systematic Review of Clinical Outcomes. Adv Radiat Oncol. 2023 Feb 8;8(4):101189.
25-Owusu-Agyemang P, Popovich SM, Zavala AM, Grosshans DR, Van Meter A, Williams UU, et al. A multi-institutional pilot survey of anesthesia practices during proton radiation therapy. Pr Radiat Oncol 2016;(6):155-9.
26-Viana LC, Cortez LS, Antunes NJ, Toledo TW, Garcia FB, Macedo TM, et al. Psychologist intervention in radiotherapy treatment for patients with or without anesthesia/sedation: Report of a Brazilian experience in a radiotherapy unit in pediatric oncology. XXIX Congress of SLAOP – Sociedad Latinoamericana de Oncología Pediátrica, Sao Paulo, 2018. [Portugese].
27-Miller R, Cohen N, Eriksson L, Fleisher L, Wiener-Kronish J, Young W Miller’s anesthesia, 8th ed. Philadelphia, PA: Elsevier, 2015.
28-Jakacki RI, Burger PC, Zhou T, Holmes EJ, Kocak M, Onar A, et al. Outcome of children with metastatic medulloblastoma treated with carboplatin during craniospinal radiotherapy: a Children's Oncology Group Phase I/II study. J Clin Oncol 2012 20;30(21):2648-53.
29-Verma V, Beethe A, LeRiger M, Kulkarni R, Zhang M, Lin C. Anesthesia complications of pediatric radiation therapy. Pr Radiat Oncol 2016;3(6):143-54.
30-Nascimento JEA, Campos AC, Borges A, Correia MITD, Tavares GM. Sociedade Brasileira de Nutrição Parenteral e Enteral e Associação Brasileira de Nutrologia. Terapia Nutricional no Perioperatório. Projeto Diretrizes: Associação Médica Brasileira e Conselho Federal de Medicina, 2011. [Portugese].
31-Aguilar-Nascimento J, Perrone F, Prado L. Preoperative fasting of 8 hours or 2 hours: what does evidence reveal? Rev Col Bras Cir 2009;(36):350-2.
32-Feldheiser A, Aziz O, Baldini G, Cox B, KCH F, Feldman L et al. Enhanced Recovery After Surgery (ERAS) for gastrointestinal surgery, part 2: Consensus statement for anaesthesia practice. Acta Anaesthesiol Scand 2016;3(60):289-334.
33-George JA, Koka R, Gan TJ, Jelin E, Boss EF, Strockbine V, et al. Review of the enhanced recovery pathway for children: perioperative anesthetic considerations. Can J Anaesth 2017;65(5)569-77.
34-Mazoit J. Pharmacokinetic/pharmacodynamic modeling of anesthetics in children: therapeutic implications. Paediatr Drugs 2006;3(8):139-50.